Acid sulfanilic
| Acid sulfanilic | |
|---|---|
 | |
 | |
 | |
| Danh pháp IUPAC | 4-Aminobenzene-1-sulfonic acid[1] |
| Tên khác | 4-Aminobenzenesulfonic acid p-Aminobenzenesulfonic acid Sulfanilic acid (not retained[1]) |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| ChEBI | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | C6H7NO3S |
| Khối lượng mol | 173,19 |
| Khối lượng riêng | 1,485 |
| Điểm nóng chảy | 288 °C (561 K; 550 °F) |
| Điểm sôi | |
| Độ hòa tan trong nước | 12,51 g/L |
| Độ axit (pKa) | 3,23 (H2O)[2] |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Acid sulfanilic (acid 4-aminobenzensulfonic) là một hợp chất hữu cơ có công thức hóa học là H3NC6H4SO3. Nó là một chất rắn màu trắng nhạt. Nó là một hợp chất có ion lưỡng tính, đó là lý do nó có nhiệt độ nóng chảy cao. Nó là một hợp chất được sử dụng phổ biến trong hóa học hữu cơ[3].
Điều chế[sửa | sửa mã nguồn]
Acid sulfanilic có thể được điều chế bằng cách sulfonat hóa anilin[4]:

Các ứng dụng[sửa | sửa mã nguồn]
Vì hợp chất này dễ dàng tạo thành các hợp chất diazo, nó được sử dụng để sản xuất các loại thuốc nhuộm và các loại thuốc sulfa[3]. Tính chất này cũng được sử dụng để phân tích định lượng các ion nitrat và nitrit bằng phản ứng kết hợp giữa diazoni với N-(1-Naphthyl)ethylendiamin, tạo ra thuốc nhuộm azo và suy ra được nồng độ của các ion nitrat hoặc nitrit từ cường độ màu của dung dịch màu đỏ thu được sau phản ứng bằng phép so màu[5]:
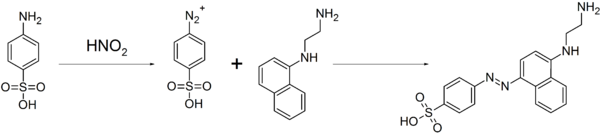
Nó cũng được sử dụng như một tiêu chuẩn trong việc phân tích quá trình đốt cháy và trong phản ứng Pauly.
Vấn đề về môi trường[sửa | sửa mã nguồn]
Vì hợp chất này được sử dụng rộng rãi, acid sulfanilic được tìm thấy trong nước thải ra từ các bãi chôn lấp rác[6]. Nó được sản xuất bằng cách khử một số thuốc nhuộm azo[7].
Các dẫn xuất[sửa | sửa mã nguồn]
- Methyl da cam (dẫn xuất với dimethylanilin)
- Acid cam 7 (dẫn xuất với 2-naphthol)[8]
- Chrysoine resorcinol (dẫn xuất với resorcinol)
Xem thêm[sửa | sửa mã nguồn]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. tr. 789. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The name ‘sulfanilic acid’ is not retained.
- ^ Haynes, William M. biên tập (2016). CRC Handbook of Chemistry and Physics (ấn bản 97). CRC Press. tr. 5–88. ISBN 978-1498754286.
- ^ a b "Sulphanilic acid". A Dictionary of Chemistry. Oxford University Press, 2000. Oxford Reference Online. Oxford University Press.
- ^ Siegfried Hauptmann: Organische Chemie, 2nd Edition, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, p. 511, ISBN 3-342-00280-8.
- ^ G. H. Jerffery; J. Bassett; J. Mendham; R. C. Denney (1989). “Colorimetry and Spectrophotometry”. Vogel's Textbook of Quantitative Chemical Analysis, 5th Edition. Longman. tr. 702. ISBN 0-582-44693-7.
- ^ Holm, John V.; Ruegge, Kirsten.; Bjerg, Poul L.; Christensen, Thomas H. (1995). “Occurrence and Distribution of Pharmaceutical Organic Compounds in the Groundwater Downgradient of a Landfill (Grindsted, Denmark)”. Environmental Science & Technology. 29 (5): 1415–1420. doi:10.1021/es00005a039. PMID 22192041.
- ^ Nam, S. (2000). “Reduction of azo dyes with zero-valent iron”. Water Research. 34 (6): 1837–1845. doi:10.1016/S0043-1354(99)00331-0.
- ^ Klaus Hunger; Peter Mischke; Wolfgang Rieper; Roderich Raue; Klaus Kunde; Aloys Engel (2005), “Azo Dyes”, Bách khoa toàn thư Ullmann về Hóa chất công nghiệp, Weinheim: Wiley-VCH, doi:10.1002/14356007.a03_245.