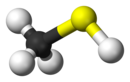
Methanethiol
| Methanethiol | |||
|---|---|---|---|
| |||
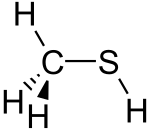 Methanethiol | |||
| Tên khác | Methyl mercaptan Mercaptomethane Methiol Thiomethyl alcohol/Thiomethanol Methylthiol | ||
| Nhận dạng | |||
| Số CAS | |||
| KEGG | |||
| ChEBI | |||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | CH4S | ||
| Khối lượng mol | 48.11 g·mol−1 | ||
| Bề ngoài | khí không màu[1] | ||
| Mùi | Bắp cải thối, đầy hơi | ||
| Khối lượng riêng | 0,9 g/mL (chất lỏng tại 0°C)[1] | ||
| Điểm nóng chảy | −123 °C (150 K; −189 °F) | ||
| Điểm sôi | 5,95 °C (279,10 K; 42,71 °F) | ||
| Độ hòa tan trong nước | 2% | ||
| Độ hòa tan | rượu, ê-te | ||
| Áp suất hơi | 1.7 atm (20°C)[1] | ||
| Độ axit (pKa) | ~10.4 | ||
| Các nguy hiểm | |||
| Phân loại của EU | |||
| NFPA 704 | |||
| Chỉ dẫn R | R12, R23, R50/53 | ||
| Chỉ dẫn S | S16 , S25, Bản mẫu:S33S60, S61 | ||
| Giới hạn nổ | 3.9%-21.8%[1] | ||
| PEL | C 10 ppm (20 mg/m³)[1] | ||
| LC50 | 3.3 ppm (chuột nhắt, 2 giờ) 675 ppm (chuột cống, 4 giờ)[2] | ||
| LD50 | 60.67 mg/kg (động vật có vú)[2] | ||
| REL | C 0.5 ppm (1 mg/m³) [15 phút][1] | ||
| IDLH | 150 ppm[1] | ||
| Các hợp chất liên quan | |||
| Hợp chất liên quan | Ethanethiol Hydrogen sulfide | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Methanethiol (còn được gọi là methyl mercaptan) là một hợp chất sulfide hữu cơ có công thức hóa học CH4S. Nó là một loại khí không màu với mùi thối đặc trưng. Nó là một chất tự nhiên được tìm thấy trong máu và não của người và động vật, cũng như trong các mô thực vật. Nó được xử lý thông qua phân động vật. Nó cũng xảy ra tự nhiên trong một số loại thực phẩm, chẳng hạn như một số loại hạt và phô mai. Nó là một trong những hợp chất chính chịu trách nhiệm cho mùi hôi miệng và mùi của căn hộ. Methanethiol được phân loại là thiol và đôi khi được viết tắt là MeSH. Nó rất dễ cháy.
Cấu trúc và phản ứng[sửa | sửa mã nguồn]
Phân tử này là tứ diện tại carbon, giống như methanol. Nó là một acid yếu, với pKa ~ 10,4, nhưng có tính acid cao hơn một triệu lần so với methanol. Muối không màu có thể thu được theo cách này:
- CH4S + CH3ONa → CH3SNa + CH3OH
Các anion thiolate kết quả là một nucleophile mạnh. Nó có thể bị oxy hóa thành dimethyl disulfide:
- 2CH4S + [O] → CH3SSCH3 + H2O
- 4CH4S + O2 → 2CH3SSCH3 + 2H2O
Quá trình oxy hóa tiếp tục đưa disulfide thành acid methanesulfonic, không mùi. Thuốc tẩy khử mùi methanethiol theo cách này
Hiện diện[sửa | sửa mã nguồn]
MeSH được phát hành dưới dạng sản phẩm phụ của bột giấy kraft trong các nhà máy bột giấy. Trong bột giấy kraft, lignin bị khử polyme do tấn công nucleophilic với ion hydrosulfide mạnh (HS−) trong môi trường có tính kiềm cao. Tuy nhiên, trong một phản ứng phụ, HS− tấn công các nhóm methoxyl (OMe) trong lignin, khử chúng để tạo ra các nhóm phenolate miễn phí (PhO−) và giải phóng MeSH. Do tính kiềm, MeS− dễ bị khử (MeSNa) và ion MeS− được hình thành cũng là một nucleophile mạnh, phản ứng tiếp với dimethyl sulfide. Các hợp chất vẫn còn trong rượu và được đốt trong nồi hơi thu hồi, trong đó sulfide được thu hồi dưới dạng natri sulfide.[3]
Methanethiol được giải phóng từ các chất hữu cơ phân rã trong đầm lầy và có trong khí tự nhiên của các khu vực nhất định, trong nhựa than đá và trong một số loại dầu thô. Nó xảy ra trong các loại thực vật và rau quả khác nhau, chẳng hạn như củ cải.
Trong nước biển bề mặt, methanethiol là sản phẩm phân hủy chính của chất chuyển hóa tảo dimethylsulfoniopropionate (DMSP). Vi khuẩn biển dường như thu được phần lớn lưu huỳnh trong protein của chúng do sự phân hủy DMSP và sự kết hợp của methanethiol, mặc dù thực tế là methanethiol có trong nước biển ở nồng độ thấp hơn nhiều so với sulfate (~ 0,3 nM so với 28 mM). Vi khuẩn trong môi trường cả có và không có oxy cũng có thể chuyển đổi methanethiol thành dimethyl sulfide (DMS), mặc dù hầu hết các DMS trong nước biển bề mặt được tạo ra bởi một con đường riêng biệt. [Cần dẫn nguồn] trong một số loại đất kỵ khí.
Methanethiol là sản phẩm phụ của quá trình chuyển hóa măng tây.[4] Khả năng sản xuất methanethiol trong nước tiểu sau khi ăn măng tây từng được cho là một đặc điểm di truyền. Nhiều nghiên cứu gần đây cho thấy rằng mùi đặc biệt trên thực tế được tạo ra bởi tất cả con người sau khi tiêu thụ măng tây, trong khi khả năng phát hiện ra nó (methanethiol là một trong nhiều thành phần trong "măng tây") thực chất là đặc điểm di truyền.[5] Các thành phần hóa học chịu trách nhiệm cho sự thay đổi mùi của nước tiểu cho thấy ngay sau 15 phút sau khi ăn măng tây.[6]
Điều chế[sửa | sửa mã nguồn]
Chuẩn bị Methanethiol được điều chế thương mại bằng phản ứng của metanol với khí hydro sulfide trên một chất xúc tác rắn có tính acid, như alumina:[7]
- CH3OH + H2S → CH4S + H2O
Mặc dù không thực tế, nó có thể được điều chế bằng phản ứng của iodomethan với thiourea.[8]
Công dụng[sửa | sửa mã nguồn]

Methanethiol chủ yếu được sử dụng để sản xuất methionine, được sử dụng như một thành phần dinh dưỡng trong gia cầm và thức ăn chăn nuôi. Methanethiol cũng được sử dụng trong ngành công nghiệp nhựa như một chất điều tiết cho phản ứng trùng hợp gốc tự do và là tiền chất trong sản xuất thuốc trừ sâu.
Mercaptan cũng được sử dụng trong ngành công nghiệp khí tự nhiên như một chất tạo mùi, do khả năng tương thích lý tưởng với khí mê-tan. Mùi "trứng thối" đặc trưng của nó được khách hàng sử dụng khí tự nhiên biết đến rộng rãi như là một dấu hiệu cho thấy có thể rò rỉ khí, thậm chí chỉ một phút.[9]
An toàn[sửa | sửa mã nguồn]
Bảng dữ liệu an toàn (SDS) liệt kê methanethiol là một loại khí không màu, dễ cháy với mùi cực kỳ mạnh và phản cảm. Ở nồng độ rất cao, nó có độc tính cao và ảnh hưởng đến hệ thần kinh trung ương. Mùi thâm nhập của nó cung cấp cảnh báo ở nồng độ nguy hiểm. Ngưỡng mùi 1 ppb đã được báo cáo.[10] Giới hạn trần OSHA của Hoa Kỳ được liệt kê là 10 ppm.
Một vụ rò rỉ methyl mercaptan nghiêm trọng đã giết chết bốn nhân viên và làm bị thương một người khác trong một cơ sở của DuPont ở La Porte, Texas, gần Houston, vào ngày 15 tháng 11 năm 2014.[11] Liều gây tử vong một nửa 60,67 mg/kg (động vật có vú)[2]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f g “NIOSH Pocket Guide to Chemical Hazards #0425”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ a b c “Methyl mercaptan”. Nguy hiểm ngay lập tức đến tính mạng hoặc sức khỏe. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Sixta, H.; Potthast, A.; Krotschek, A. W., Chemical Pulping Processes. In Handbook of Pulp, Sixta, H., Ed. Wiley-VCH Verlag GmbH & Co.: Weinheim, 2006; Vol. 1, p 169 (109-510).
- ^ Richer, Decker, Belin, Imbs, Montastruc, Giudicelli: "Odorous urine in man after asparagus", British Journal of Clinical Pharmacology, May 1989
- ^ Lison M, Blondheim SH, Melmed RN (1980). “A polymorphism of the ability to smell urinary metabolites of asparagus”. Br Med J. 281 (6256): 1676–8. doi:10.1136/bmj.281.6256.1676. PMC 1715705. PMID 7448566.
- ^ Skinny On: Discovery Channel Lưu trữ 2008-02-29 tại Wayback Machine
- ^ Norell, John; Louthan, Rector P. (1988). “Thiols”. Kirk-Othmer Concise Encylclopedia of Chemical Technology (ấn bản 3). New York: John Wiley & Sons, Inc. tr. 946–963. ISBN 978-0471801047.
- ^ Reid, E. Emmet (1958). Organic Chemistry of Bivalent Sulfur. 1. New York: Chemical Publishing Company, Inc. tr. 32–33, 38.
- ^ “SafeGase: About Natural Gas:”. Bản gốc lưu trữ ngày 3 tháng 4 năm 2019. Truy cập ngày 15 tháng 3 năm 2019.
- ^ Devos, M; F. Patte; J. Rouault; P. Lafort; L. J. Van Gemert (1990). Standardized Human Olfactory Thresholds. Oxford: IRL Press. tr. 101. ISBN 0199631468.
- ^ “HazMat Management Magazine article:”. Bản gốc lưu trữ ngày 16 tháng 7 năm 2017. Truy cập ngày 15 tháng 3 năm 2019.