Thali(I) iodide
| Thali(I) iodide | |
|---|---|
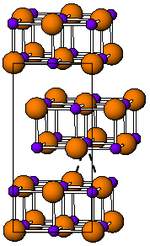 Cấu trúc của thali(I) iodide | |
| Danh pháp IUPAC | Thali iodide |
| Tên khác | Thali iodide Thali monoiodide Thalơ iodide |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | TlI |
| Khối lượng mol | 331,287 g/mol[1] |
| Bề ngoài | Tinh thể màu vàng[1] |
| Khối lượng riêng | 7,1 g/cm³[1] |
| Điểm nóng chảy | 441,7 °C (714,8 K; 827,1 °F)[1] |
| Điểm sôi | 824 °C (1.097 K; 1.515 °F)[1] |
| Độ hòa tan trong nước | 0,085 g/L (25 ℃)[1] |
| Độ hòa tan | tan trong alcohol[1] tạo phức với thioure |
| MagSus | -82,2·10-6 cm³/mol[2] |
| Các nguy hiểm | |
| Phân loại của EU | Rất độc (T+) Nguy hiểm cho môi trường (N) |
| Nguy hiểm chính | độc tính cao |
| Chỉ dẫn R | R26/28, R33, R51/53 |
| Chỉ dẫn S | (S1/2), S13, S28, S45, S61 |
| Điểm bắt lửa | Không bắt lửa |
| Các hợp chất liên quan | |
| Anion khác | Thali(I) fluoride Thali(I) chloride Thali(I) bromide |
| Cation khác | Galli(I) iodide Indi(I) iodide |
| Hợp chất liên quan | Thủy ngân(II) iodide Chì(II) iodide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Thali(I) iodide là một hợp chất vô cơ với công thức hóa học TlI. Nó là một trong số ít các iodide kim loại không tan trong nước, cùng với AgI, SnI2, SnI4, PbI2 và HgI2.
Điều chế[sửa | sửa mã nguồn]
TlI có thể được hình thành trong dung dịch nước khi cho bất cứ muối thali(I) nào hòa tan với muối iodide. Nó cũng được hình thành như là một sản phẩm phụ khi cho phenol tác dụng với thali(I) acetat.
Tính chất vật lý[sửa | sửa mã nguồn]
Ở nhiệt độ phòng, TlI có màu vàng và có cấu trúc thuộc hệ tinh thể trực thoi[3] có thể được coi là cấu trúc NaCl bị méo mó. Hình dạng méo mó được cho là do tương tác liên kết Tl–Tl, khoảng cách Tl–Tl gần nhất là 383 pm[4]. Ở 175 ℃, dạng màu vàng biến đổi thành dạng màu đỏ. Quá trình chuyển đổi giai đoạn này được đi kèm với khoảng hai bậc tăng cường độ dẫn điện. Cấu trúc CsI có thể ổn định đến nhiệt độ phòng bằng cách pha tạp TlI với các iodide khác như RbI, CsI, KI, AgI, TlBr và TlCl[5]. Do đó, sự có mặt của các tạp chất có thể giúp cho sự tồn tại của các khối TlI và hình thoi ở xung quanh. Dưới áp lực cao, 160 kbar, TlI trở thành một chất dẫn điện. Các màng mỏng TlI nanomet phát triển trên các chất nền LiF, NaCl hoặc KBr thể hiện cấu trúc đá khối[6].
Ứng dụng[sửa | sửa mã nguồn]
Thali(I) iodide được thêm vào bóng đèn hồ quang thủy ngân để cải thiện hiệu suất của chúng[7]. Ánh sáng được tạo ra nằm chủ yếu trong vùng xanh lá cây của ánh sáng nhìn thấy được và ít bị hấp thụ bởi nước, do đó chúng được sử dụng để chiếu sáng dưới nước.[8]
Thali(I) iodide cũng được dùng để pha tạp trong các tinh thể nháp nháy NaI hoặc CsI với hàm lượng rất nhỏ để tạo ra các thiết bị ghi đo bức xạ.
An toàn[sửa | sửa mã nguồn]
Giống như tất cả các hợp chất tali khác, tali(I) iodide là chất rất độc.
Hợp chất khác[sửa | sửa mã nguồn]
TlI còn tạo một số hợp chất với CS(NH2)2, như TlI·6CS(NH2)2 là tinh thể không màu, nóng chảy ở 187–190 °C (369–374 °F; 460–463 K).[9]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f g Haynes, p. 4.94
- ^ Haynes, p. 4.136
- ^ Lowndes, R. P.; Perry, C. H. (1973). “Molecular structure and anharmonicity in thallium iodide”. The Journal of Chemical Physics. 58: 271. doi:10.1063/1.1678917.
- ^ Mudring, Anja-Verena (2007). “Thallium Halides – New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements”. European Journal of Inorganic Chemistry. 2007 (6): 882–890. doi:10.1002/ejic.200600975.
- ^ Sultana, Saima; Rafiuddin (2009). “Electrical conductivity in TlI–TiO2 composite solid electrolyte”. Physica B: Condensed Matter. 404: 36. doi:10.1016/j.physb.2008.10.002.
- ^ Schulz, L. G. (1951). “Polymorphism of cesium and thallium halides”. Acta Crystallographica. 4 (6): 487. doi:10.1107/S0365110X51001641.
- ^ Reiling, Gilbert H. (1964). “Characteristics of Mercury Vapor–Metallic Iodide Arc Lamps”. Journal of the Optical Society of America. 54 (4): 532. doi:10.1364/JOSA.54.000532.
- ^ Underwater Journal and information bulletin, IPC Science and Technology Press, (1973), tr. 245.
- ^ Journal of inorganic and general chemistry (bằng tiếng Đức). 347. Johann Ambrosius Barth. 1966. tr. 160–166.
| HI | He | ||||||||||||||||
| LiI | BeI2 | BI3 | CI4 | NI3 | I2O4, I2O5, I4O9 | IF, IF3, IF5, IF7 | Ne | ||||||||||
| NaI | MgI2 | AlI3 | SiI4 | PI3, P2I4 | S | ICl, ICl3 | Ar | ||||||||||
| KI | CaI2 | ScI3 | TiI2, TiI3, TiI4 | VI2, VI3, VOI2 | CrI2, CrI3, CrI4 | MnI2 | FeI2, FeI3 | CoI2 | NiI2 | CuI, CuI2 | ZnI2 | GaI, GaI2, GaI3 | GeI2, GeI4 | AsI3 | Se | IBr | Kr |
| RbI | SrI2 | YI3 | ZrI2, ZrI4 | NbI2, NbI3, NbI4, NbI5 | MoI2, MoI3, MoI4 | TcI3, TcI4 | RuI2, RuI3 | RhI3 | PdI2 | AgI | CdI2 | InI3 | SnI2, SnI4 | SbI3 | TeI4 | I | Xe |
| CsI | BaI2 | HfI4 | TaI3, TaI4, TaI5 | WI2, WI3, WI4 | ReI, ReI2, ReI3, ReI4 | OsI, OsI2, OsI3 | IrI, IrI2, IrI3 | PtI2, PtI3, PtI4 | AuI,AuI3 | Hg2I2, HgI2 | TlI, TlI3 | PbI2, PbI4 | BiI2, BiI3 | PoI2. PoI4 | AtI | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| LaI2, LaI3 | CeI2, CeI3 | PrI2, PrI3 | NdI2, NdI3 | PmI3 | SmI2, SmI3 | EuI2, EuI3 | GdI2, GdI3 | TbI3 | DyI2, DyI3 | HoI3 | ErI3 | TmI2, TmI3 | YbI2, YbI3 | LuI3 | |||
| Ac | ThI2, ThI3, ThI4 | PaI3, PaI4, PaI5 | UI3, UI4, UI5 | NpI3 | PuI3 | AmI2, AmI3 | CmI2, CmI3 | BkI3 | CfI2, CfI3 | EsI3 | Fm | Md | No | Lr | |||