Benzen
| Benzene | |
|---|---|
 Benzen | |
| Danh pháp IUPAC | Benzene |
| Tên khác | Benzol cyclohexa-1,3,5-trien |
| Nhận dạng | |
| Số CAS | |
| Số RTECS | CY1400000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | C6H6 |
| Khối lượng mol | 78,1121 g/mol |
| Bề ngoài | Chất lỏng không màu |
| Khối lượng riêng | 0,8786 g/cm³, chất lỏng |
| Điểm nóng chảy | 5,5 °C (278,6 K) |
| Điểm sôi | 80,1 °C (353,2 K) |
| Độ hòa tan trong nước | 1,79 g/L (25 °C) |
| Độ nhớt | 0.7528 cP (10 °C) 0.6076 cP (25 °C) 0.4965 cP (40 °C) 0.3075 cP (80 °C) |
| Mômen lưỡng cực | 0 D |
| Các nguy hiểm | |
| Phân loại của EU | (F) Ung thư nhóm 1 Đột biến nhóm 2 Độc (T) |
| NFPA 704 | |
| Chỉ dẫn R | R45, 46, 11, 36/38, 48/23/24/25, 65 |
| Chỉ dẫn S | S53, 45 |
| Điểm bắt lửa | −11 °C |
| Các hợp chất liên quan | |
| Hợp chất liên quan | Toluen Borazin |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Benzene là một hợp chất hữu cơ có công thức hoá học C6H6. Benzene là một hydrocarbon thơm, trong điều kiện bình thường là một chất lỏng không màu, mùi dịu ngọt dễ chịu, dễ cháy. Benzene tan kém trong nước và rượu [1] Vì chỉ chứa carbon và hydro nên benzene là một hydrocarbon.
Benzene là thành phần tự nhiên của dầu thô và là một trong những hóa chất dầu cơ bản. Do các liên kết pi liên tục tuần hoàn giữa các nguyên tử carbon, benzen được phân loại là hydrocarbon thơm, [n] - annulen ([6] - annulen) thứ hai. Nó đôi khi được viết tắt là PhH. Benzen là một chất lỏng không màu, rất dễ cháy và có mùi thơm, nó tạo ra mùi thơm xung quanh các trạm xăng. Nó được sử dụng chủ yếu như một tiền chất để sản xuất các hóa chất có cấu trúc phức tạp hơn, chẳng hạn như ethylbenzen và cumen, trong đó hàng tỷ kg được sản xuất hàng năm. Vì benzen có số octan cao, các dẫn xuất thơm như toluen và xylen thường chiếm tới 25% xăng. Bản thân benzen đã bị giới hạn ở mức dưới 1% trong xăng vì nó là chất gây ung thư ở người. Hầu hết các ứng dụng phi công nghiệp cũng bị hạn chế vì lý do tương tự.
Lịch sử
[sửa | sửa mã nguồn]Khám phá
[sửa | sửa mã nguồn]Từ "benzene" có nguồn gốc từ "nhựa benzoin", một loại nhựa thơm được các dược sĩ và nước hoa châu Âu biết đến từ thế kỷ 16 như một sản phẩm của Đông Nam Á.[2] Một vật liệu có tính acid được lấy từ benzoin bằng cách thăng hoa và được đặt tên là "hoa của benzoin", hay acid benzoic. Do đó hydrocarbon có nguồn gốc từ acid benzoic thu được tên là benzin, benzol hoặc benzen.[3] Michael Faraday lần đầu tiên phân lập và xác định benzen vào năm 1825 từ dư lượng dầu có nguồn gốc từ việc sản xuất khí phát sáng, đặt cho nó cái tên bicarburet của hydro.[4][5] Năm 1833, Eilhard Mitscherlich đã sản xuất nó bằng cách chưng cất acid benzoic (từ nhựa benzoin) và vôi. Ông đã đặt cho hợp chất tên là benzin.[6] Năm 1836, nhà hóa học người Pháp Auguste Laurent đặt tên cho chất này là "phène";[7] từ này đã trở thành từ gốc của từ tiếng Anh "phenol", đó là benzen được hydroxyl hóa và " phenyl", gốc tự do được hình thành do sự trừu tượng của một nguyên tử hydro (gốc tự do H •) từ benzene.
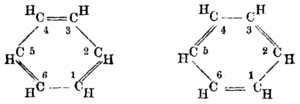
Năm 1845, Charles Mansfield, làm việc dưới quyền August von von Hofmann, đã tách benzen từ nhựa than đá.[8] Bốn năm sau, Mansfield bắt đầu sản xuất benzen ở quy mô công nghiệp đầu tiên, dựa trên phương pháp than đá.[9][10] Dần dần, ý thức phát triển giữa các nhà hóa học rằng một số chất có liên quan về mặt hóa học với benzen, bao gồm một họ hóa học đa dạng. Năm 1855, Hofmann đã sử dụng từ "thơm" để chỉ định mối quan hệ gia đình này, vì tính chất đặc trưng của nhiều thành viên trong họ chất này.[11] Năm 1997, benzen được phát hiện trong không gian liên sao.[12]
Công thức vòng
[sửa | sửa mã nguồn]
Công thức thực nghiệm cho benzene đã được biết đến từ lâu, nhưng cấu trúc không bão hòa cao của nó, chỉ với một nguyên tử hydro cho mỗi nguyên tử carbon, là thách thức để xác định. Archibald Scott Couper năm 1858 và Joseph Loschmidt năm 1861 [19] đã đề xuất các cấu trúc có thể chứa nhiều liên kết đôi hoặc nhiều vòng, nhưng sau đó có quá ít bằng chứng để giúp các nhà hóa học quyết định bất kỳ cấu trúc cụ thể nào.
Năm 1865, nhà hóa học người Đức Friedrich August Kekulé xuất bản một bài báo bằng tiếng Pháp (khi đó ông đang giảng dạy tại vùng Bỉ sử dụng Pháp ngữ) cho thấy cấu trúc benzen chứa một vòng gồm sáu nguyên tử carbon với các liên kết đơn và đôi xen kẽ. Năm sau, ông xuất bản một bài báo bằng tiếng Đức về cùng một chủ đề.[20][21] Kekulé đã sử dụng bằng chứng tích lũy trong những năm qua, cụ thể là, dường như luôn luôn chỉ có một đồng phân của bất kỳ đơn chất hóa học nào của benzen và luôn luôn xuất hiện chính xác ba đồng phân của mọi dẫn xuất bị loại bỏ, mô hình meta và para của sự thay thế aren để hỗ trợ cho cấu trúc đề xuất của ông.[22] Vòng đối xứng của Kekulé có thể giải thích những sự việc gây tò mò này, cũng như tỷ lệ carbon-hydro 1:1 của benzen.
Sự hiểu biết mới này về benzen, và do đó của tất cả các hợp chất thơm, đã được chứng minh là rất quan trọng đối với cả hóa học tinh khiết và hóa học ứng dụng mà vào năm 1890, Hiệp hội Hóa học Đức đã tổ chức một sự đánh giá cao về khám phá của Kekulé, kỷ niệm năm thứ 25 của bài báo về benzen đầu tiên của ông. Ở đây Kekulé đã nói về việc tạo ra lý thuyết. Ông nói rằng ông đã phát hiện ra hình dạng chiếc nhẫn của phân tử benzen sau khi có tiếng vang hay giấc mơ ban ngày của một con rắn tự giữ đuôi của mình (đây là một biểu tượng phổ biến trong nhiều nền văn hóa cổ đại được gọi là Ouroboros hoặc nút thắt vô tận).[23] Tầm nhìn này đã đến với ông sau nhiều năm nghiên cứu bản chất của các liên kết carbon-carbon. Mất 7 năm sau khi ông giải quyết vấn đề làm thế nào các nguyên tử carbon có thể liên kết với tối đa bốn nguyên tử khác cùng một lúc. Thật kỳ lạ, một mô tả tương tự, hài hước về benzen đã xuất hiện vào năm 1886 trong một cuốn sách nhỏ có tựa đề Berichte der Durstigen Chemischen Gesellschaft (Tạp chí của Hiệp hội hóa học khát nước), một bản nhái của Berichte der Deutschen Chemischen Gesellschaft, một vòng tròn, thay vì rắn như trong giai thoại của Kekulé.[24] Một số nhà sử học cho rằng nhại lại là một cây đèn thần của giai thoại rắn, có thể đã được biết đến qua truyền miệng ngay cả khi nó chưa xuất hiện trên báo in.[3] Bài phát biểu năm 1890 của Kekulé [25] trong đó giai thoại này xuất hiện đã được dịch sang tiếng Anh.[26] Nếu giai thoại là ký ức của một sự kiện có thật, thì các tình huống được đề cập trong câu chuyện cho thấy nó phải xảy ra vào đầu năm 1862.[27]
Bản chất tuần hoàn của benzen cuối cùng đã được xác nhận bởi nhà tinh thể học Kathleen Lonsdale vào năm 1929.[28][29]
Danh pháp
[sửa | sửa mã nguồn]Nhà hóa học người Đức Wilhelm Korner đã đề xuất các tiền tố ortho-, meta-, para- để phân biệt các dẫn xuất benzen thay thế vào năm 1867; tuy nhiên, ông không sử dụng các tiền tố để phân biệt vị trí tương đối của các nhóm thế trên vòng benzen.[30] Đó là nhà hóa học người Đức Karl Gräbe vào năm 1869, lần đầu tiên sử dụng tiền tố ortho-, meta-, para- để biểu thị các vị trí tương đối cụ thể của các nhóm thế trên một vòng thơm thay thế di (viz, naphthalen).[31] Năm 1870, nhà hóa học người Đức Viktor Meyer lần đầu tiên áp dụng danh pháp của Gräbe cho benzen.[32]
Ứng dụng ban đầu
[sửa | sửa mã nguồn]Trong thế kỷ 19 và đầu thế kỷ 20, benzen được sử dụng làm kem dưỡng da sau cạo râu vì mùi dễ chịu của nó. Trước những năm 1920, benzen thường được sử dụng làm dung môi công nghiệp, đặc biệt là để tẩy kim loại. Khi độc tính của nó trở nên rõ ràng, benzen được thay thế bởi các dung môi khác, đặc biệt là toluen (methylbenzen), có tính chất vật lý tương tự nhưng không gây ung thư.
Năm 1903, Ludwig Roselius đã phổ biến việc sử dụng benzen để khử caffein cà phê. Phát hiện này đã dẫn đến việc sản xuất Sanka. Quá trình này sau đó đã bị ngưng. Benzen trong lịch sử đã được sử dụng như một thành phần quan trọng trong nhiều sản phẩm tiêu dùng như Cờ lê lỏng, một số dụng cụ cạo sơn, xi măng cao su, tẩy trang tại chỗ và các sản phẩm khác. Việc sản xuất một số công thức chứa benzen này đã ngừng vào khoảng năm 1950, mặc dù cờ lê lỏng vẫn tiếp tục chứa một lượng đáng kể benzen cho đến cuối những năm 1970.[33]
Xuất hiện ngoài tự nhiên
[sửa | sửa mã nguồn]Một lượng nhỏ benzen được tìm thấy trong dầu mỏ và than đá. Nó là sản phẩm phụ của quá trình đốt cháy không hoàn toàn của nhiều vật liệu. Đối với mục đích thương mại, cho đến Thế chiến II, hầu hết benzen được lấy làm sản phẩm phụ của sản xuất than cốc (hay "dầu nhẹ lò than") cho ngành công nghiệp thép. Tuy nhiên, trong những năm 1950, nhu cầu về benzen tăng lên, đặc biệt là từ ngành công nghiệp polymer đang phát triển, đòi hỏi phải sản xuất benzen từ dầu mỏ. Ngày nay, hầu hết benzen đến từ ngành công nghiệp hóa dầu, chỉ có một phần nhỏ được sản xuất từ than đá.[34]
Cấu trúc phân tử
[sửa | sửa mã nguồn]
Cấu trúc mà Kekulé đưa ra hầu như không thuyết phục được các nhà khoa học đương thời, vì căn cứ vào công thức phân tử thì phân tử benzene thể hiện tính không no cao nhưng rất khó tham gia phản ứng cộng, ngược lại benzene rất dễ tham gia phản ứng thế. Tuy nhiên vào năm 1929, công thức của Kekulé đã được công nhận bởi Kathleen Lonsdale.
Theo phân tích quang phổ thì góc liên kết giữa các nguyên tử trong benzen đều là 120 độ, các liên kết C-C đều như nhau (140 pm), lớn hơn liên kết đôi đơn lẻ và nhỏ hơn liên kết đơn (136 pm và 147 pm). Điều này được giải thích qua thuyết lai hoá obitan như sau: trong phân tử benzen, các nguyên tử C ở trạng thái lai hoá sp2 liên kết với nhau và với các nguyên tử H thành mặt phẳng phân tử benzen, các obitan p vuông góc với mặt phẳng không chỉ liên kết thành cặp mà liên kết với nhau thành hệ liên hợp. Do vậy mà liên kết đôi ở benzen thường bền hơn so với các hợp chất có liên kết đôi khác, dẫn đến các tính chất đặc trưng mà người ta gọi là tính thơm.
Tính chất
[sửa | sửa mã nguồn]Benzene trong điều kiện có xúc tác nickel, nhiệt độ cao cộng với khí hydro tạo ra cyclohexan. Khi có chiếu sáng, benzene tác dụng với khí chlor tạo ra lindan C6H6Cl6 (còn gọi là thuốc trừ sâu ba số 6, thuốc trừ sâu 6-6-6), một thuốc trừ sâu hoạt tính rất mạnh, đã bị cấm.
Khi có acid Lewis, benzen phản ứng với methylchloride tạo ra toluen.
Ngoài ra, benzen có thể được chuyển thành nhiều hợp chất khác theo cách này. Ví dụ như amphetamin:
C6H6 + CH2=CH-CH2Cl -> C6H5CH2CH(CH3)Cl (xúc tác AlCl3)
C6H5CH2CH(CH3)Cl + NH3 -> C6H5CH2CH(CH3)NH3+Cl-
Thủy phân sản phẩm, thu được amphetamin.
Phản ứng thế electrophyl
[sửa | sửa mã nguồn]Benzen phản ứng thế với halogen(X2) khi có sắt hoặc acid Lewis (AlCl3) tạo phenyl halide (C6H5X), phản ứng với acid nitric đặc có xúc tác acid sulfuric đậm đặc tạo nitro benzen (trong điều kiện ngặt nghèo hơn - acid bốc khói và nhiệt độ cao - sinh ra TNB), phản ứng với acid sulfuric đậm đặc chưng cất nước thành acid benzosulfonic. Quy tắc chung được nêu trong hình dưới.

Nếu như có thêm nhóm thế thì phản ứng thế vào nhân thơm sẽ nhanh hơn hoặc chậm hơn tuỳ vào bản chất nhóm thế:
| Dạng định hướng đồng phân | Nhóm thế tiêu biểu | Mức độ | Hoạt hoá/Phản hoạt hoá |
|---|---|---|---|
| Định hướng ortho, para | - OH, - NH2 (-NHR, -NR2) | Mạnh | Hoạt hoá |
| - OR | Trung bình | ||
| - NHC(R)=O | |||
| - OC(R)=O | |||
| - R, - Aren | |||
| - X (halogen) | Yếu | Phản hoạt hoá | |
| Định hướng meta | -C(R)=O, - CH=O | ||
| - COOH, - C(NH2)=O | |||
| - COOR | |||
| -SO3H, - CN, - CF3 | Trung bình | ||
| -NO2, -NR3, -SR3 | Mạnh |
Điều chế
[sửa | sửa mã nguồn]Trime hóa Acetylen
[sửa | sửa mã nguồn]Cách điều chế : https://www.youtube.com/watch?v=_HNUjoNEmtc[35]
Dùng acid Benzoic
[sửa | sửa mã nguồn]Cho acid benzoic tác dụng với natri hydroxide theo phản ứng:

Quá trình trải qua 2 phản ứng :
Điều kiện : nhiệt độ cao
Từ các hydrocarbon nặng
[sửa | sửa mã nguồn]Từ các hydrocarbon mạch thẳng dài
Độc tính
[sửa | sửa mã nguồn]Benzene có mùi thơm dễ chịu giống mùi bánh ngọt vừa nướng xong, nhưng mùi này có hại cho sức khoẻ (gây bệnh bạch cầu). Ngoài ra, khi hít benzene vào, có thể gây vô sinh, cần lưu ý khi tiếp xúc trực tiếp với benzene. Có thể gây bệnh ung thư máu. Benzene khi rơi vào da sẽ gây bỏng rát.
Đồng phân vị trí nhóm thế
[sửa | sửa mã nguồn]Nếu có hai nhóm thế đính vào nhân thơm thì cho ra 3 đồng phân: thế 1,2- là ortho- (o-), thế 1,3- là meta- (m-), thế 1,4- là para- (p-).
Ứng dụng
[sửa | sửa mã nguồn]Ngày nay một lượng lớn benzen chủ yếu để:
- Sản xuất styren cho tổng hợp polymer.
- Sản xuất cumen cho việc sản xuất cùng lúc aceton và phenol.
- Sản xuất cyclohexan tổng hợp tơ nylon.
- Làm dung môi, sản xuất dược liệu.
Các dẫn xuất và đồng đẳng
[sửa | sửa mã nguồn]Đồng đẳng
[sửa | sửa mã nguồn]- Toluen: có được từ chưng cất nhựa than đá hoặc cho benzene phản ứng với metylclorua có acid Lewis, ứng dụng chính là sản xuất thuốc nổ TNT và làm dung môi.
- Xylen: có ba đồng phân o-, m-, p-, là sản phẩm của quá trình chưng cất hoá dầu, dùng trong kỹ nghệ.
- Cumen: có được nhờ cộng benzene vào propylen.
- dãy đồng đẳng của benzen có công thức tổng quát CnH2n-6 với
Dẫn xuất
[sửa | sửa mã nguồn]- Phenol: có được nhờ oxy hoá cumen.
- Anilin.
- acid benzoic.
- Styren.
- Paracetamol.
Chú thích
[sửa | sửa mã nguồn]- ^ Critics pointed out a problem with Kekulé's original (1865) structure for benzene: Whenever benzene underwent substitution at the ortho position, two distinguishable isomers should have resulted, depending on whether a double bond or a single bond existed between the carbon atoms to which the substituents were attached; however, no such isomers were observed. In 1872, Kekulé suggested that benzene had two complementary structures and that these forms rapidly interconverted, so that if there were a double bond between any pair of carbon atoms at one instant, that double bond would become a single bond at the next instant (and vice versa). To provide a mechanism for the conversion process, Kekulé proposed that the valency of an atom is determined by the frequency with which it collided with its neighbors in a molecule. As the carbon atoms in the benzene ring collided with each other, each carbon atom would collide twice with one neighbor during a given interval and then twice with its other neighbor during the next interval. Thus, a double bond would exist with one neighbor during the first interval and with the other neighbor during the next interval. Therefore, between the carbon atoms of benzene there were no fixed (i.e., constant) and distinct single or double bonds; instead, the bonds between the carbon atoms were identical. See pages 86–89 of Auguste Kekulé (1872) "Ueber einige Condensationsprodukte des Aldehyds" (On some condensation products of aldehydes), Liebig's Annalen der Chemie und Pharmacie, 162(1): 77–124, 309–320. From p. 89: "Das einfachste Mittel aller Stöße eines Kohlenstoffatoms ergiebt sich aus der Summe der Stöße der beiden ersten Zeiteinheiten, die sich dann periodisch wiederholen. … man sieht daher, daß jedes Kohlenstoffatom mit den beiden anderen, … daß diese Verschiedenheit nur eine scheinbare, aber keine wirkliche ist." (The simplest average of all the collisions of a carbon atom [in benzene] comes from the sum of the collisions during the first two units of time, which then periodically repeat. … thus one sees that each carbon atom collides equally often with the two others against which it bumps, [and] thus stands in exactly the same relation with its two neighbors. The usual structural formula for benzene expresses, of course, only the collisions that occur during one unit of time, thus during one phase, and so one is led to the view [that] doubly substituted derivatives [of benzene] must be different at positions 1,2 and 1,6 [of the benzene ring]. If the idea [that was] just presented — or a similar one — can be regarded as correct, then [it] follows therefrom that this difference [between the bonds at positions 1,2 and 1,6] is only an apparent [one], not a real [one].)
- ^ “Benzene trên www.eco-usa.net”. Bản gốc lưu trữ ngày 12 tháng 5 năm 2008. Truy cập ngày 15 tháng 6 năm 2008.
- ^ The word "benzoin" is derived from the Arabic expression "luban jawi", or "frankincense of Java".Morris, Edwin T. (1984). Fragrance: The Story of Perfume from Cleopatra to Chanel. Charles Scribner's Sons. tr. 101. ISBN 978-0684181950.
- ^ a b Rocke, A. J. (1985). “Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory”. Annals of Science. 42 (4): 355–81. doi:10.1080/00033798500200411.
- ^ Faraday, M. (1825). “On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat”. Philosophical Transactions of the Royal Society. 115: 440–466. doi:10.1098/rstl.1825.0022. JSTOR 107752. On pages 443–450, Faraday discusses "bicarburet of hydrogen" (benzene). On pages 449–450, he shows that benzene's empirical formula is C6H6, although he doesn't realize it because he (like most chemists at that time) used the wrong atomic mass for carbon (6 instead of 12).
- ^ Kaiser, R. (1968). “Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968”. Angewandte Chemie International Edition in English. 7 (5): 345–350. doi:10.1002/anie.196803451.
- ^ Mitscherlich, E. (1834). “Über das Benzol und die Säuren der Oel- und Talgarten” [On benzol and oily and fatty types of acids]. Annalen der Pharmacie. 9 (1): 39–48. doi:10.1002/jlac.18340090103. In a footnote on page 43, Liebig, the journal's editor, suggested changing Mitscherlich's original name for benzene (namely, "benzin") to "benzol", because the suffix "-in" suggested that it was an alkaloid (e.g., Chinin (quinine)), which benzene isn't, whereas the suffix "-ol" suggested that it was oily, which benzene is. Thus on page 44, Mitscherlich states: "Da diese Flüssigkeit aus der Benzoësäure gewonnen wird, und wahrscheinlich mit den Benzoylverbindungen im Zusammenhang steht, so gibt man ihr am besten den Namen Benzol, da der Name Benzoïn schon für die mit dem Bittermandelöl isomerische Verbindung von Liebig und Wöhler gewählt worden ist." (Since this liquid [benzene] is obtained from benzoic acid and probably is related to benzoyl compounds, the best name for it is "benzol", since the name "benzoïn" has already been chosen, by Liebig and Wöhler, for the compound that's isomeric with the oil of bitter almonds [benzaldehyde].)
- ^ Laurent, Auguste (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique," Annales de Chemie et de Physique, vol. 63, pp. 27–45, see p. 44: "Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage." (I give the name of "phène" (φαινω, I illuminate) to the fundamental radical of the preceding acids, because benzene is found in illuminating gas.)
- ^ Hofmann, A. W. (1845) "Ueber eine sichere Reaction auf Benzol" (On a reliable test for benzene), Annalen der Chemie und Pharmacie, vol. 55, pp. 200–205; on pp. 204–205, Hofmann found benzene in coal tar oil.
- ^ Mansfield Charles Blachford (1849). “Untersuchung des Steinkohlentheers”. Annalen der Chemie und Pharmacie. 69 (2): 162–180. doi:10.1002/jlac.18490690203.
- ^ Charles Mansfield filed for (ngày 11 tháng 11 năm 1847) and received (May 1848) a patent (no. 11,960) for the fractional distillation of coal tar.
- ^ Hoffman, Augustus W. (1856). “On insolinic acid”. Proceedings of the Royal Society. 8: 1–3. doi:10.1098/rspl.1856.0002.
The existence and mode of formation of insolinic acid prove that to the series of monobasic aromatic acids, Cn2Hn2-8O4, the lowest known term of which is benzoic acid, ….
[Note: The empirical formulas of organic compounds that appear in Hofmann's article (p. 3) are based upon an atomic mass of carbon of 6 (instead of 12) and an atomic mass of oxygen of 8 (instead of 16).] - ^ Infrared Space Observatory's Discovery of C4H2, C6H2, and Benzene in CRL 618
- ^ Claus, Adolph K.L. (1867) "Theoretische Betrachtungen und deren Anwendungen zur Systematik der organischen Chemie" (Theoretical considerations and their applications to the classification scheme of organic chemistry), Berichte über die Verhandlungen der Naturforschenden Gesellschaft zu Freiburg im Breisgau (Reports of the Proceedings of the Scientific Society of Freiburg in Breisgau), 4: 116-381. In the section Aromatischen Verbindungen (aromatic compounds), pp. 315-347, Claus presents Kekulé's hypothetical structure for benzene (p. 317), presents objections to it, presents an alternative geometry (p. 320), and concludes that his alternative is correct (p.326). See also figures on p. 354 or p. 379.
- ^ Dewar James (1867). “On the oxidation of phenyl alcohol, and a mechanical arrangement adapted to illustrate structure in the non-saturated hydrocarbons”. Proceedings of the Royal Society of Edinburgh. 6: 82–86. doi:10.1017/S0370164600045387.
- ^ Ladenburg Albert (1869). “Bemerkungen zur aromatischen Theorie” [Observations on the aromatic theory]. Berichte der Deutschen Chemischen Gesellschaft. 2: 140–142. doi:10.1002/cber.18690020171.
- ^ Armstrong Henry E (1887). “An explanation of the laws which govern substitution in the case of benzenoid compounds”. Journal of the Chemical Society. 51: 258–268 [264]. doi:10.1039/ct8875100258.
- ^ Thiele, Johannes (1899) "Zur Kenntnis der ungesättigten Verbindungen" (On our knowledge of unsaturated compounds), Justus Liebig’s Annalen der Chemie306: 87–142; see: "VIII. Die aromatischen Verbindungen. Das Benzol." (VIII. The aromatic compounds. Benzene.), pp. 125–129. See further: Thiele (1901) "Zur Kenntnis der ungesättigen Verbindungen," Justus Liebig’s Annalen der Chemie, 319: 129–143.
- ^ In his 1890 paper, Armstrong represented benzene nuclei within polycyclic benzenoids by placing inside the benzene nuclei a letter "C", an abbreviation of the word "centric". Centric affinities (i.e., bonds) acted within a designated cycle of carbon atoms. From p. 102: " … benzene, according to this view, may be represented by a double ring, in fact." See:
- ^ Loschmidt, J. (1861). Chemische Studien (bằng tiếng Đức). Vienna, Austria-Hungary: Carl Gerold's Sohn. tr. 30, 65.
- ^ Kekulé, F. A. (1865). “Sur la constitution des substances aromatiques”. Bulletin de la Société Chimique de Paris. 3: 98–110. On p. 100, Kekulé suggests that the carbon atoms of benzene could form a "chaîne fermée" (a closed chain, a loop).
- ^ Kekulé, F. A. (1866). “Untersuchungen über aromatische Verbindungen (Investigations of aromatic compounds)”. Liebigs Annalen der Chemie und Pharmacie. 137 (2): 129–36. doi:10.1002/jlac.18661370202.
- ^ Rocke, A. J. (2010). Image and Reality: Kekule, Kopp, and the Scientific Imagination. University of Chicago Press. tr. 186–227. ISBN 978-0226723358..
- ^ Read, John (1995). From alchemy to chemistry. New York: Dover Publications. tr. 179–180. ISBN 9780486286907.
- ^ English translationWilcox, David H.; Greenbaum, Frederick R. (1965). “Kekule's benzene ring theory: A subject for lighthearted banter”. Journal of Chemical Education. 42 (5): 266–67. Bibcode:1965JChEd..42..266W. doi:10.1021/ed042p266.
- ^ Kekulé, F. A. (1890). “Benzolfest: Rede”. Berichte der Deutschen Chemischen Gesellschaft. 23: 1302–11. doi:10.1002/cber.189002301204.
- ^ Benfey O. T. (1958). “August Kekulé and the Birth of the Structural Theory of Organic Chemistry in 1858”. Journal of Chemical Education. 35 (1): 21–23. Bibcode:1958JChEd..35...21B. doi:10.1021/ed035p21.
- ^ Gillis Jean (1966). “Auguste Kekulé et son oeuvre, réalisée à Gand de 1858 à 1867”. Mémoires de la Classe des Sciences - Académie Royale des Sciences, des Lettres et des Beaux-arts de Belgique. 37 (1): 1–40.
- ^ Lonsdale, K. (1929). “The Structure of the Benzene Ring in Hexamethylbenzene”. Proceedings of the Royal Society. 123A (792): 494–515. Bibcode:1929RSPSA.123..494L. doi:10.1098/rspa.1929.0081.
- ^ Lonsdale, K. (1931). “An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method”. Proceedings of the Royal Society. 133A (822): 536–553. Bibcode:1931RSPSA.133..536L. doi:10.1098/rspa.1931.0166.
- ^ See:
- ^ Graebe (1869) "Ueber die Constitution des Naphthalins" (On the structure of naphthalene), Annalen der Chemie und Pharmacie, 149: 20–28; see especially p. 26.
- ^ Victor Meyer (1870) "Untersuchungen über die Constitution der zweifach-substituirten Benzole" (Investigations into the structure of di-substituted benzenes), Annalen der Chemie und Pharmacie, 156: 265–301; see especially pp. 299–300.
- ^ Williams, P.R.D.; Knutsen, J.S.; Atkinson, C.; Madl, A.K.; Paustenbach, D.J. (2007). “Airborne Concentrations of Benzene Associated with the Historical Use of Some Formulations of Liquid Wrench”. Journal of Occupational and Environmental Hygiene. 4 (8): 547–561. doi:10.1080/15459620701446642. PMID 17558801.
- ^ “Ullmann's Encyclopedia of Industrial Chemistry”. Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. 2005. doi:10.1002/14356007.a03_475. ISBN 978-3527306732.
- ^ Astral Chemistry (11 tháng 3 năm 2017), Reppe Chemistry: Synthesis of benzene from acetylene, truy cập ngày 20 tháng 5 năm 2024
Xem thêm
[sửa | sửa mã nguồn]Liên kết ngoài
[sửa | sửa mã nguồn]| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Benzen. |
- Benzene tại Encyclopædia Britannica (tiếng Anh)
- Benzen at The Periodic Table of Videos (University of Nottingham)
- International Chemical Safety Card 0015
- USEPA Summary of Benzen Toxicity
- NIOSH Pocket Guide to Chemical Hazards
- Benzen tại PubChem
- Dept. of Health and Human Services: TR-289: Toxicology and Carcinogensis Studies of Benzen
- Video Podcast of Sir John Cadogan giving a lecture on Benzen since Faraday, in 1991
- Substance profile
- Benzen TOXicology Data NETwork
- NLM Hazardous Substances Databank – Benzen
- Benzen tại Từ điển bách khoa Việt Nam

![{\displaystyle {\ce {3C2H2->[{\text{C / Ni / Fe, 500 - 600°C, }}p][{\text{Khí trơ}}]C6H6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b121b143b282acb52819c88bad77d9b60a1b0630)



