Chất lưu siêu tới hạn
Bài này không có nguồn tham khảo nào. |
Chất lưu siêu tới hạn là một dạng vật chất tồn tại trong điều kiện áp suất và nhiệt độ cao hơn điểm tới hạn. Trong điều kiện này, vật chất có trạng thái đặc biệt, vừa lỏng vừa khí, ví dụ như vừa có thể khuếch tán trong không trung như chất khí, vừa có thể thấm qua vật chất như chất lỏng. Ngoài ra ở điều kiện nhiệt độ và áp suất gần với điểm tới hạn, thay đổi nhỏ của các thông số này dẫn đến thay đổi lớn về mật độ của vật chất.
Chất lưu siêu tới hạn được dùng trong một số trường hợp để thay thế các dung môi hữu cơ. Nước và carbon dioxide là phổ biến nhất, dùng trong quá trình lấy caffein ra khỏi nông sản, hoặc dùng trong lò phản ứng nước siêu tới hạn.
Tính chất[sửa | sửa mã nguồn]
Nói chung, chất lưu siêu tới hạn có các đặc tính giữa chất khí và chất lỏng. Trong Bảng 1, các thuộc tính quan trọng được hiển thị cho một số chất thường được sử dụng làm chất lưu siêu tới hạn.
| Dung môi | Khối lượng phân tử | Nhiệt độ tới hạn | Áp suất tới hạn | Tỉ trọng tới hạn |
|---|---|---|---|---|
| g/mol | K | MPa (atm) | g/cm³ | |
| Carbon dioxide (CO2) | 44,01 | 304,1 | 7,38 (72,8) | 0,469 |
| Nước (H2O) | 18,015 | 647,096 | 22,064 (217,755) | 0,322 |
| Methane (CH4) | 16,04 | 190,4 | 4,60 (45,4) | 0,162 |
| Ethane (C2H6) | 30,07 | 305,3 | 4,87 (48,1) | 0,203 |
| Propane (C3H8) | 44,09 | 369,8 | 4,25 (41,9) | 0,217 |
| Ethylene (C2H4) | 28,05 | 282,4 | 5,04 (49,7) | 0,215 |
| Propylene (C3H6) | 42,08 | 364,9 | 4,60 (45,4) | 0,232 |
| Methanol (CH3OH) | 32,04 | 512,6 | 8,09 (79,8) | 0,272 |
| Ethanol (C2H5OH) | 46,07 | 513,9 | 6,14 (60,6) | 0,276 |
| Acetone (C3H6O) | 58,08 | 508,1 | 4,70 (46,4) | 0,278 |
| Nitrous oxit (N2O) | 44,013 | 306,57 | 7,35 (72,5) | 0,452 |
Bảng 2 cho thấy mật độ, độ khuếch tán và độ nhớt của chất lỏng, chất khí và chất lưu siêu tới hạn điển hình.
| Tỉ trọng(kg/m³) | Độ nhớt (µPa·s) | Độ khuếch tán (mm²/s) | |
|---|---|---|---|
| Khí | 1 | 10 | 1–10 |
| Chất lưu siêu tới hạn | 100–1000 | 50–100 | 0,01–0,1 |
| Lỏng | 1000 | 500–1000 | 0,001 |
Ngoài ra, không có sức căng bề mặt trong chất lưu siêu tới hạn, vì không có ranh giới pha lỏng/khí. Bằng cách thay đổi áp suất và nhiệt độ của chất lưu, các đặc tính có thể được "điều chỉnh" để giống như chất lỏng hơn hoặc giống như chất khí hơn. Một trong những tính chất quan trọng nhất là độ hòa tan của vật liệu trong chất lưu. Độ hòa tan trong chất lưu siêu tới hạn có xu hướng tăng theo mật độ của chất lưu (ở nhiệt độ không đổi). Vì mật độ tăng theo áp suất, độ hòa tan có xu hướng tăng theo áp suất. Mối quan hệ với nhiệt độ phức tạp hơn một chút. Ở mật độ không đổi, độ hòa tan sẽ tăng theo nhiệt độ. Tuy nhiên, gần đến điểm tới hạn, mật độ có thể giảm mạnh khi nhiệt độ tăng nhẹ. Do đó, gần với nhiệt độ tới hạn, độ hòa tan thường giảm khi nhiệt độ tăng, sau đó tăng trở lại.[2]
Tất cả các chất lưu siêu tới hạn hoàn toàn có thể trộn lẫn với nhau, vì vậy đối với hỗn hợp, một pha duy nhất có thể được đảm bảo nếu vượt quá điểm tới hạn của hỗn hợp. Điểm tới hạn của hỗn hợp hai chất có thể được ước tính là giá trị trung bình cộng của nhiệt độ và áp suất tới hạn của hai thành phần,
- Tc(hỗn hợp) = (phần mol A) × TcA + (phần mol B) × TcB.
Để có độ chính xác cao hơn, điểm tới hạn có thể được tính bằng các phương trình trạng thái, chẳng hạn như Peng Robinson hoặc phương pháp đóng góp nhóm. Các thuộc tính khác, chẳng hạn như mật độ, cũng có thể được tính bằng các phương trình trạng thái.[3]
Sơ đồ pha[sửa | sửa mã nguồn]

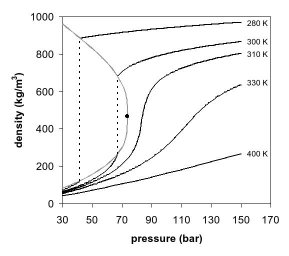
Hình 1 và 2 cho thấy các hình chiếu hai chiều của sơ đồ pha. Trong sơ đồ pha nhiệt độ-áp suất (Hình 1), sự sôi tách biệt vùng chất khí và chất lỏng và kết thúc tại điểm tới hạn, nơi các pha lỏng và khí biến mất để trở thành một pha siêu tới hạn.
Sự xuất hiện của một pha cũng có thể được quan sát trong sơ đồ pha áp suất-mật độ cho carbon dioxide (Hình 2). Ở nhiệt độ thấp hơn nhiệt độ tới hạn, ví dụ, 280 K, khi áp suất tăng, khí bị nén và cuối cùng (chỉ hơn 40 bar) ngưng tụ thành chất lỏng đậm đặc hơn nhiều, dẫn đến một đường gián đoạn gián đoạn (đường chấm chấm giữa pha lỏng và pha khí). Hệ thống bao gồm 2 pha ở trạng thái cân bằng giữa pha lỏng đậm đặc hơn và pha khí có mật độ thấp hơn. Khi nhiệt độ gần nhiệt độ tới hạn (300 K), mật độ của chất khí ở trạng thái cân bằng trở nên cao hơn và chất lỏng thấp hơn. Tại điểm tới hạn, (304,1 K và 7,38 MPa (73,8 bar)), không có sự khác biệt về mật độ, và hai pha trở thành pha chất lưu. Do đó, trên nhiệt độ tới hạn, một chất khí không thể bị hóa lỏng bởi áp suất. Ở nhiệt độ cao hơn một chút (310 K), trong vùng lân cận của áp suất tới hạn, đường này gần như không có. Áp suất tăng nhỏ gây ra sự gia tăng lớn về mật độ của pha siêu tới hạn. Nhiều tính chất vật lý khác cũng hiển thị độ dốc lớn với áp suất gần điểm tới hạn, ví dụ: Độ nhớt, độ thấm tương đối và cường độ dung môi, tất cả đều liên quan chặt chẽ đến mật độ. Ở nhiệt độ cao hơn, chất lưu bắt đầu hoạt động giống như chất khí, như có thể thấy trong Hình 2. Đối với carbon dioxide ở 400 K, mật độ tăng gần như tuyến tính với áp suất.
Nhiều khí điều áp thực sự là chất lưu siêu tới hạn. Ví dụ, nitơ có điểm tới hạn là 126,2 K (-147 °C) và 3,4 MPa (34 bar). Do đó, nitơ (hoặc khí nén) trong một bình chứa khí trên áp suất này thực sự là một chất lưu siêu tới hạn. Ở nhiệt độ phòng, mức nhiệt độ cao hơn nhiệt độ tới hạn của nó, và do đó nó hoạt động như một chất khí, tương tự như CO2 ở 400 K nói trên. Tuy nhiên, nó không thể được hóa lỏng bằng áp suất, trừ khi được làm mát dưới nhiệt độ tới hạn.
Xem thêm[sửa | sửa mã nguồn]
Tham khảo[sửa | sửa mã nguồn]
- ^ Edit Székely. “What is a supercritical fluid?”. Budapest University of Technology and Economics. Truy cập ngày 26 tháng 6 năm 2014.
- ^ “Supercritical Fluid Extraction, Density Considerations”. Truy cập ngày 20 tháng 11 năm 2007.
- ^ A. A. Clifford (ngày 4 tháng 12 năm 2007). “Calculation of Thermodynamic Properties of CO2 using Peng–Robinson equation of state”. Critical Processes Ltd. Bản gốc lưu trữ ngày 5 tháng 5 năm 2008. Truy cập ngày 20 tháng 11 năm 2007.
Liên kết ngoài[sửa | sửa mã nguồn]
- Handy calculator Lưu trữ 2008-05-05 tại Wayback Machine for density, enthalpy, entropy and other thermodynamic data of supercritical CO2
- animated presentation describing what a supercritical fluid is Lưu trữ 2008-12-06 tại Wayback Machine (broken link)
- NewScientist Environment FOUND:The hottest water on Earth Lưu trữ 2008-09-24 tại Wayback Machine
- Poliakoff, Martyn (ngày 28 tháng 4 năm 2008). “Supercritical fluids”. Test Tube. Brady Haran for the University of Nottingham.
