Thể cắt nối

Thể cắt nối (spliceosome) là phức hợp nuclêôprôtêin chịu trách nhiệm chủ yếu trong việc cắt bỏ các đoạn intrôn ra khỏi mRNA sơ khai và ghép nối các đoạn êxôn với nhau, tạo nên phân tử mRNA trưởng thành ở sinh vật nhân thực, từ đó mRNA này mới có thể làm khuôn dịch mã.[2][3]
Đây là thuật ngữ trong di truyền học phân tử, dịch từ tiếng Anh là "spliceosome" (IPA: /splaɪs'əʊsʌm/) dùng để chỉ một cỗ máy phân tử thực hiện giai đoạn quyết định là cắt nối RNA trong quá trình xử lý RNA.
Tổng quan[sửa | sửa mã nguồn]
Lược sử[sửa | sửa mã nguồn]

Vào năm 1977, những công trình nghiên cứu từ các phòng thí nghiệm của Phillip Sharp và Richard J. Roberts đã cho biết: gen của các sinh vật nhân thực bị "phân tách" thành các đoạn khác nhau dọc theo phân tử DNA.[4][5] Các vùng mã hóa của gen - theo tên gọi "chuẩn" của nó, phải có thông tin di truyền về các amino acid do nó mã hoá - lại có những miền có chuỗi mã hoá xen kẽ với những miền không mang chuỗi bộ ba mã hóa nào, nghĩa là không liên quan gì đến đến biểu hiện thành prôtêin. Kiểu cấu tạo này của gen được gọi là gen phân mảnh đã được tìm thấy khi các mRNA ở virut Ađênô được lai với các đoạn của DNA virut đơn chuỗi, tách nhờ enđônuclêaza.[4] Từ đó, các nhà nghiên cứu đã xác định vùng mã hoá gồm các chuỗi không mã hoá gọi là "intron" sẽ phải rời khỏi mRNA sơ khai qua một quá trình mà Phillip Sharp đặt tên là "splicing" (tức ghép nối, sau này đặt tên chính thức là RNA splicing). P. Sharp và R.J. Roberts đã được trao giải Nobel về sinh lý học và y học năm 1993.
Từ nguyên[sửa | sửa mã nguồn]
Spliceosome là từ ghép giữa splice (ghép hay nối hoặc bện) do P. Sharp đặt ra với từ some (lấy từ soma, tức cơ thể hay vật thể).[6][7] Do đó dịch là thể cắt nối.
Thành phần[sửa | sửa mã nguồn]
Thể cắt nối lớn[sửa | sửa mã nguồn]
- Mỗi thể cắt nối (spliceosome) được xem là một bào quan, thường có khối lượng rất lớn (thường tới vài MDa tức hàng triệu Đan-tôn), gồm một số phân tử RNA kết hợp với nhiều phân tử prôtêin.[8] Thể cắt nối là một phức hợp phân tử có bản chất là RNP, gồm năm phân tử RNA nhân nhỏ (small nuclear RNA, viết tắt là snRNA) liên kết với 80 - 100 prôtêin liên quan.[3] Khi các snRNA này đã kết hợp với các prôtêin cần thiết thì tạo ra phức hợp RNP (ribônuclêôprôtêin), được gọi riêng là snRNP (ribônuclêô-prôtêin hạt nhân nhỏ, từ snRNP đọc là "snurp" - IPA: /ɛs njuː ɑː piː/).[3]
- Năm phân tử RNA nhân nhỏ (snRNA) chủ chốt được đặt tên là U1, U2, U4, U5 và U6,[8] do chúng giàu uraxin.[3]
- Gần đây, các nhà nghiên cứu mới thu được từ cấu trúc tinh thể của một nhóm intrôn cho thấy rằng thể cắt nối thực sự là một ribôzym và nó sử dụng cơ chế xúc tác ion-hai kim loại, trong đó có kẽm.[9][10][11][12]
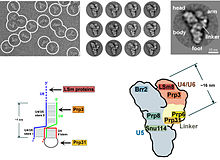
Khung phân tử của thể cắt nối - ở độ phân giải gần nguyên tử - cho thấy thành phần của U5 snRNP tạo thành một "giàn giáo" trung tâm và neo trung tâm cho xúc tác của enzym. Trong cấu trúc của thể cắt nối ở người có tất cả năm Mg2+ trong phức hợp nấm men được bảo tồn.[14][15]
Thể cắt nối nhỏ[sửa | sửa mã nguồn]
Một số sinh vật nhân thực có một loại thể cắt nối khác, gọi là thể cắt nối nhỏ (minor spliceosome).[16] Loại này cũng là snRNA nhưng nghèo U hơn, gồm U11, U12, U4atac và U6atac và U5. Đây là các tiểu đơn vị (subunit) kết hợp với tiểu đơn vị khác là một loại intron tiền mRNA hiếm gặp ký hiệu là loại U12,[17] tuy cũng có ngoại lệ [18] và thấy ở dịch chất của sợi nhánh của neuron gọi là dendroplasm.[19]
Chu kỳ thể cắt nối[sửa | sửa mã nguồn]

- Các thành phần tạo nên thể cắt nối và hoạt động của phức hợp thường tạo nên một chu trình. Trong hình bên mô tả chu trình, thì các snRNP U1, U2, U4, U5 và U6 liên kết với mRNA sơ khai và với nhau theo trật tự nhất định để tạo nên bộ phận cơ bản của thể cắt nối. Sau đó, nó xúc tác hai phản ứng trans ester hóa dẫn đến việc tách các êxôn (sáng và đỏ sẫm) và bỏ các intrôn (màu xanh). Mặc dù quá trình thủy phân ATP là không bắt buộc cần cho các phản ứng ester hóa này, nhưng nó cung cấp năng lượng cho sự sắp xếp lại cấu trúc thể cắt nối trong chu kỳ.
- Ở sinh vật nhân thực bậc cao, có thêm thành phần hnRNP được gọi là U2AF, liên kết với vùng giàu pyrimidine gần vị trí nối 3', hỗ trợ sự liên kết của U2 snRNP với mRNA sơ khai. U2AF cũng có thể tương tác với các prôtêin khác cần cho cắt nối qua một miền có chứa chuỗi đi-peptit lặp lại xêrin-acginin (gọi là môtip SR). Điểm A nhánh trong mRNA in bằng chữ đậm.[20]
Tham khảo[sửa | sửa mã nguồn]
- Butcher SE (2011). “Chapter 8. The Spliceosome and Its Metal Ions”. Trong Sigel A, Sigel H, Sigel RK (biên tập). Structural and catalytic roles of metal ions in RNA. Metal Ions in Life Sciences. 9. RSC Publishing. tr. 235–51. doi:10.1039/9781849732512-00235. ISBN 978-1-84973-094-5.
- Nilsen TW (tháng 12 năm 2003). “The spliceosome: the most complex macromolecular machine in the cell?”. BioEssays. 25 (12): 1147–9. doi:10.1002/bies.10394. PMID 14635248.
Nguồn trích dẫn[sửa | sửa mã nguồn]
- ^ Patricia M. Watson & Dennis K. Watson. “Alternative Splicing in Prostate and Breast Cancer”.
- ^ Timothy W. Nilsen. “Spliceosome”.
- ^ a b c d Will CL, Lührmann R (tháng 7 năm 2011). “Spliceosome structure and function”. Cold Spring Harbor Perspectives in Biology. 3 (7): a003707. doi:10.1101/cshperspect.a003707. PMC 3119917. PMID 21441581.
- ^ a b Berget SM, Moore C, Sharp PA (tháng 8 năm 1977). “Spliced segments at the 5' terminus of adenovirus 2 late mRNA”. Proceedings of the National Academy of Sciences of the United States of America. 74 (8): 3171–5. Bibcode:1977PNAS...74.3171B. doi:10.1073/pnas.74.8.3171. PMC 431482. PMID 269380.
- ^ Chow LT, Roberts JM, Lewis JB, Broker TR (tháng 8 năm 1977). “A map of cytoplasmic RNA transcripts from lytic adenovirus type 2, determined by electron microscopy of RNA:DNA hybrids”. Cell. 11 (4): 819–36. doi:10.1016/0092-8674(77)90294-X. PMID 890740.
- ^ “spliceosome”.
- ^ “Spliceosome”.
- ^ a b Cindy L. Will & Reinhard Lührmann. “Spliceosome Structure and Function”.
- ^ Toor N, Keating KS, Taylor SD, Pyle AM (tháng 4 năm 2008). “Crystal structure of a self-spliced group II intron”. Science. 320 (5872): 77–82. Bibcode:2008Sci...320...77T. doi:10.1126/science.1153803. PMC 4406475. PMID 18388288.
- ^ Agafonov DE, Deckert J, Wolf E, Odenwälder P, Bessonov S, Will CL, Urlaub H, Lührmann R (tháng 7 năm 2011). “Semiquantitative proteomic analysis of the human spliceosome via a novel two-dimensional gel electrophoresis method”. Molecular and Cellular Biology. 31 (13): 2667–82. doi:10.1128/mcb.05266-11. PMC 3133382. PMID 21536652.
- ^ Kuhn AN, van Santen MA, Schwienhorst A, Urlaub H, Lührmann R (tháng 1 năm 2009). “Stalling of spliceosome assembly at distinct stages by small-molecule inhibitors of protein acetylation and deacetylation”. RNA. 15 (1): 153–75. doi:10.1261/rna.1332609. PMC 2612777. PMID 19029308.
- ^ Patil V, Canzoneri JC, Samatov TR, Lührmann R, Oyelere AK (tháng 9 năm 2012). “Molecular architecture of zinc chelating small molecules that inhibit spliceosome assembly at an early stage”. RNA. 18 (9): 1605–11. doi:10.1261/rna.034819.112. PMC 3425776. PMID 22832025.
- ^ Häcker I, Sander B, Golas MM, Wolf E, Karagöz E, Kastner B, Stark H, Fabrizio P, Lührmann R (tháng 11 năm 2008). “Localization of Prp8, Brr2, Snu114 and U4/U6 proteins in the yeast tri-snRNP by electron microscopy”. Nature Structural & Molecular Biology. 15 (11): 1206–12. doi:10.1038/nsmb.1506. PMID 18953335.
- ^ Yan C, Hang J, Wan R, Huang M, Wong CC, Shi Y (tháng 9 năm 2015). “Structure of a yeast spliceosome at 3.6-angstrom resolution”. Science. 349 (6253): 1182–91. Bibcode:2015Sci...349.1182Y. doi:10.1126/science.aac7629. PMID 26292707.
- ^ Zhang X, Yan C, Hang J, Finci LI, Lei J, Shi Y (tháng 5 năm 2017). “An Atomic Structure of the Human Spliceosome”. Cell. 169 (5): 918–929.e14. doi:10.1016/j.cell.2017.04.033. PMID 28502770.
- ^ Patel AA, Steitz JA (tháng 12 năm 2003). “Splicing double: insights from the second spliceosome”. Nature Reviews. Molecular Cell Biology. 4 (12): 960–70. doi:10.1038/nrm1259. PMID 14685174.
- ^ Pessa HK, Will CL, Meng X, Schneider C, Watkins NJ, Perälä N, Nymark M, Turunen JJ, Lührmann R, Frilander MJ (tháng 6 năm 2008). “Minor spliceosome components are predominantly localized in the nucleus”. Proceedings of the National Academy of Sciences of the United States of America. 105 (25): 8655–60. doi:10.1073/pnas.0803646105. PMC 2438382. PMID 18559850.
- ^ Denis MM, Tolley ND, Bunting M, Schwertz H, Jiang H, Lindemann S, Yost CC, Rubner FJ, Albertine KH, Swoboda KJ, Fratto CM, Tolley E, Kraiss LW, McIntyre TM, Zimmerman GA, Weyrich AS (tháng 8 năm 2005). “Escaping the nuclear confines: signal-dependent pre-mRNA splicing in anucleate platelets”. Cell. 122 (3): 379–91. doi:10.1016/j.cell.2005.06.015. PMC 4401993. PMID 16096058.
- ^ Glanzer J, Miyashiro KY, Sul JY, Barrett L, Belt B, Haydon P, Eberwine J (tháng 11 năm 2005). “RNA splicing capability of live neuronal dendrites”. Proceedings of the National Academy of Sciences of the United States of America. 102 (46): 16859–64. Bibcode:2005PNAS..10216859G. doi:10.1073/pnas.0503783102. PMC 1277967. PMID 16275927.
- ^ a b Saravana R K Murthy. “The spliceosomal splicing cycle”.
Liên kết ngoài[sửa | sửa mã nguồn]
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Thể cắt nối. |