Chuyển vị Hofmann
Chuyển vị Hofmann là phản ứng hữu cơ mà chất phản ứng là một amide chuyển thành sản phẩm là amin bậc 1 có ít hơn 1 carbon.[1][2][3][4]
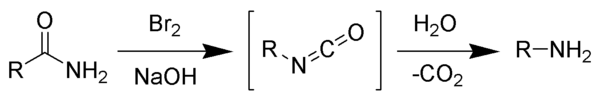
Tên phản ứng được đặt theo August Wilhelm von Hofmann. Phản ứng này đôi khi cũng được gọi là giáng cấp Hofmann, và không nên nhầm lẫn với phản ứng tách Hofmann.
Cơ chế[sửa | sửa mã nguồn]
Phản ứng của brom với natri hydroxide tạo thành natri hypobromit tại chỗ. Sau đó, natri hypobromit phản ứng với amide thành isocyanat là hợp chất trung gian. Không thể hình thành hợp chất nitren trung gian là do nếu có hình thành nitren thì nó sẽ biến đổi thành acid hydroxamic như một sản phẩm phụ, mà điều này chưa bao giờ quan sát thấy trong thực nghiệm. Isocyanat trung gian bị thủy phân thành amin bậc 1 và carbon dioxide.[2]
- Base lấy proton từ nhóm NH có tính acid, thu được anion.
- Các anion phản ứng với bromine trong phản ứng thay thế α tạo ra N-bromoamide.
- Base lấy proton của amide còn lại tạo ra anion bromoamide.
- Anion bromoamide chuyển vị khi nhóm R chuyển vị từ vị trí carbon của nhóm chức carbonyl đến nguyên tử nitơ cùng lúc với việc ion bromide rời khỏi phân tử, tạo ra một isocyanate.
- Isocyanate cộng nước theo cơ chế cộng nucleophil, tạo ra acid carbamic (còn gọi là urethane).
- Acid carbamic mất CO2 dễ dàng, thu được sản phẩm là amin.
Biến thể[sửa | sửa mã nguồn]
Nhiều thuốc thử có thể thay thế cho nước brom. Natri hypochlorit,[5] chì tetraacetat,[6] N-bromosuccinimide, (bis(trifluoroacetoxy)iodo)benzene,[7] và 1,8-diazabicyclo(5.4.0)undec-7-en (DBU) đều xảy ra phản ứng chuyển vị Hofmann. Trong ví dụ sau, hợp chất trung gian isocyanat phản ứng metanol, tạo thành carbamate.[8]
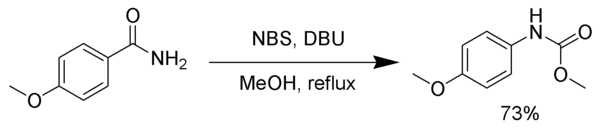
Tình huống tương tự, isocyanate trung gian có thể phản ứng với alcohol tert-butylic tạo thành nhóm bảo vệ amin mang tên tert-butoxycarbonyl (viết tắt là Boc)
Chuyển vị Hofmann cũng có thể được sử dụng để tạo racarbamate từ các amide có carbon ở vị trí α,β-chưa no, amide có nhóm hydroxy ở vị trí α [2][9] hoặc tạo ra hợp chất nitrile từ amide dạng α,β-acetylenic với hiệu suất cao (≈70%)[2][10].
Ứng dụng[sửa | sửa mã nguồn]
- amide aliphatic và amide thơm chuyển thành amin aliphatic và amin thơm
- Trong các chế phẩm của acid anthranilic từ phthalimide
- Acid nicotinic chuyển thành 3-Aminopyridine
- Cấu trúc đối xứng của α-phenyl propanamide không thay đổi sau phản ứng chuyển vị Hofmann.
- Gabapentin từ phản ứng mono-amin hoá anhydride acid 1,1-cyclohexane diacetic với amonia trở thành hợp chất trung gian acid mono-amide 1,1-cyclohexane diacetic; sau đó mới đến chuyển vị Hoffmann: Bằng sáng chế Hoa Kỳ số 20.080.103.334
Xem thêm[sửa | sửa mã nguồn]
- Chuyển vị Beckmann
- Chuyển vị Curtius
- Phản ứng Iodoform
- Chuyển vị Lossen
- Phản ứng Schmidt
- Giáng cấp Weerman
Tham khảo[sửa | sửa mã nguồn]
- ^ Hofmann, A. W. (1881). “Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide” [On the action of bromine in alkaline solution on amides]. Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 2725–2736. doi:10.1002/cber.188101402242.
- ^ a b c d Everett, Wallis; Lane, John (1946). The Hofmann Reaction. Organic Reactions. 3. tr. 267–306. doi:10.1002/0471264180.or003.07. ISBN 9780471005285.
- ^ Shioiri, Takayuki (1991). Degradation Reactions. Comprehensive Organic Synthesis. 6. tr. 795–828. doi:10.1016/B978-0-08-052349-1.00172-4. ISBN 9780080359298.
- ^ “Phản ứng chuyển vị phân tử” (PDF). Bản gốc (PDF) lưu trữ ngày 27 tháng 4 năm 2019.
- ^ Mohan, Ram S.; Monk, Keith A. (1999). “The Hofmann Rearrangement Using Household Bleach: Synthesis of 3-Nitroaniline”. Journal of Chemical Education. 76 (12): 1717. Bibcode:1999JChEd..76.1717M. doi:10.1021/ed076p1717.
- ^ Baumgarten, Henry; Smith, Howard; Staklis, Andris (1975). “Reactions of amines. XVIII. Oxidative rearrangement of amides with lead tetraacetate”. The Journal of Organic Chemistry. 40 (24): 3554–3561. doi:10.1021/jo00912a019.
- ^ Almond, Merrick R.; Stimmel, Julie B.; Thompson, Alan; Loudon, Marc (1988). “Hofmann Rearrangement under Mildly Acidic Conditions using [I,I-Bis(Trifluoroacetoxy)]iodobenzene: Cyclobutylamine Hydrochloride from Cyclobutanecarboxamide”. Organic Syntheses. 66: 132. doi:10.15227/orgsyn.066.0132.
- ^ Keillor, Jeffrey W.; Huang, Xicai (2002). “Methyl Carbamate Formation via Modified Hofmann Rearrangement Reactions: Methyl N-(p-Methoxyphenyl)carbamate”. Organic Syntheses. 78: 234. doi:10.15227/orgsyn.078.0234.
- ^ Weerman, R.A. (1913). “Einwirkung von Natriumhypochlorit auf Amide ungesättigter Säuren”. Justus Liebigs Annalen der Chemie. 401 (1): 1–20. doi:10.1002/jlac.19134010102.
- ^ Rinkes, I. J. (1920). “De l'action de l'Hypochlorite de Sodium sur les Amides D'Acides”. Recueil des Travaux Chimiques des Pays-Bas. 39 (12): 704–710. doi:10.1002/recl.19200391204.
Tư liệu[sửa | sửa mã nguồn]
- Clayden, Jonathan (2007). Organic Chemistry. Oxford University Press Inc. tr. 1073. ISBN 978-0-19-850346-0.
- Fieser, Louis F. (1962). Advanced Organic Chemistry. Reinhold Publishing Corporation, Chapman & Hall, Ltd. tr. 499–501.
